Gli elettroni si muovono. Questo lo sanno anche i bambini: i libri di scienze contengono sempre qualche disegno di un atomo rappresentato come un nucleo centrale con degli elettroni che vi girano attorno. E quando gli atomi sono legati tra loro in una molecola? Gli elettroni continuano a muoversi? Certamente. Anzi: tendono a distribuirsi sempre in modo da mantenere l’energia della molecola quanto più bassa possibile, spostandosi da un punto ad un altro.
Possiamo vedere questo movimento? Non direttamente, e per due motivi: il primo è che gli elettroni sono molto piccoli. Il secondo è che sono molto veloci. In modo indiretto, però, i ricercatori sono riusciti a seguire il movimento degli elettroni in molecole estremamente semplici, come la biatomiche H2 e O2. Tracciare lo spostamento degli elettroni in molecole più grandi è una sfida che nessuno aveva tentato prima del gruppo di lavoro internazionale che ha compreso ricercatori del politecnico di Milano, del CNR, dell’università di Trieste, della scuola di matematica e fisica di Belfast, e dell’università autonoma di Madrid, e che pochi giorni fa ha pubblicato sulla rivista Science i risultati dello studio del movimento degli elettroni nella fenilalanina.
La fenilalanina è un amminoacido, una molecola che viene utilizzata dal nostro corpo per produrre proteine ed è quindi fondamentale per la nostra dieta. È anche il principale costituente dell’aspartame, e per questo motivo sulle bottiglie di molte bibite commerciali compare la scritta “Può essere fonte di fenilalanina”. Capire come si muovano gli elettroni al suo interno può essere molto utile per la biochimica e la ricerca medica. Ma è anche estremamente interessante dal punto di vista della chimica fisica stessa.
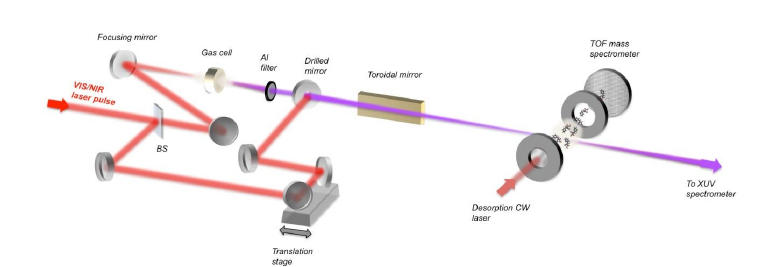
Il professore Mauro Nisoli, del politecnico di Milano, ci ha parlato dell’esperimento che il suo team ha realizzato. La strumentazione che hanno utilizzato è relativamente complicata:
L’idea alla base, però, è semplice: strappare un elettrone alla molecola, colpendola con un impulso luminoso ad alta energia (sfruttando raggi X e ultravioletti). Questo provocherà una buca di potenziale (cioè un punto in cui si verifica un eccesso di carica positiva perché manca un elettrone) e tutti gli altri elettroni dovranno spostarsi per riuscire a distribuirsi nel modo più efficiente possibile. Sarà quindi possibile osservare questo movimento.
Prima di tutto, però, si vaporizza la fenilalanina. “Per portare la molecola in fase gassosa”, dice Nisoli, “si prende la polverina di amminoacido e la si pressa su un film molto sottile di tantalio nella camera a vuoto. Dopodichè la lamina viene riscaldata dall’esterno con un terzo laser, che serve soltanto a scaldare. Quando le molecole superano la soglia di evaporazione vengono mandate fuori, senza però rompersi”. Si forma quindi un flusso di molecole in fase gassosa, e su di esso viene focalizzato un impulso ad attosecondi (un attosecondo equivale a un miliardesimo di miliardesimo di secondo) con radiazioni X-UV. Sovrapposti a questa luce laser, ma con ritardo variabile, vengono inviati anche degli impulsi da 4,5 femtosecondi (cioè 4,5 milionesimi di miliardesimo di secondo) nel vicino infrarosso.
Ma, se per innescare il movimento di elettroni utilizziamo il laser a raggi XUV, a che serve quello infrarosso-visibile?
Serve a vedere l’effetto del primo. “Il fenomeno è dato dall’XUV, ma senza l’IR non lo misuriamo”, spiega Nisoli.
Per usare una metafora, possiamo dire che gli elettroni della fenilalanina sono come delle palle da biliardo su un tavolo in una stanza buia. Possiamo utilizzare un primo impulso luminoso come una stecca, da lanciare sul tavolo per colpire una palla. Ma poi abbiamo bisogno di un altro impulso luminoso, un flash fotografico, per poter vedere cosa è accaduto sul tavolo stesso.
“È il tipico schema di Pump and Probe, cioè pompo una radiazione (pump) e poi un secondo impulso di sonda (probe) va a vedere cosa è successo. In questo caso l’impulso di sonda è particolare perché interagisce fortemente con il campione, producendo lo ione doppiamente carico. Noi abbiamo visto che l’efficienza di formazione di questo ione doppiamente carico deriva dal moto degli elettroni.” Infatti, la luce IR riesce a ionizzare soprattutto vicino al gruppo NH2, togliendo elettroni da questo sito. E lo fa in modo più o meno facile a seconda della configurazione elettronica che si ha in corrispondenza di questo punto. Andando a vedere l’aumento o la diminuzione della produzione di questo ione doppiamente carico, si vede come la carica si è mossa in corrispondenza dell’NH2. Per capire quanto ione immonio viene prodotto, i ricercatori utilizzano uno spettrometro di massa a tempo di volo.
“Il trucco è che questa seconda fase di ionizzazione, in corrispondenza del gruppo che comprende l’azoto, dipende fortemente da come è fatta la struttura elettronica” spiega Nisoli.
In altre parole, se si scopre quante volte il gruppo dell’azoto si è separato dalla molecola, si sa anche come si sono spostati gli elettroni.
Grazie a queste informazioni, i ricercatori sono riusciti a realizzare una simulazione del movimento degli elettroni nella molecola:
In realtà, il filmato mostra il movimento della buca di potenziale, e per estensione si intuisce lo spostamento degli elettroni attorno ad essa. Ovviamente, a muoversi sono gli elettroni, perché i nuclei (a carica positiva) sono considerati fermi per l’approssimazione di Born Opennheimer. Questa approssimazione “è vera nei primi femtosecondi, poi i nuclei cominciano a vibrare. Ma, oggi come oggi, nessuna simulazione riesce a considerare l’andamento degli elettroni in una molecola così complessa tenendo conto dei nuclei”. Sarebbe infatti necessario risolvere l’equazione di Schroedinger per ogni singola particella.
Come si può vedere dal contatore del filmato, i tempi in cui questo spostamento di elettroni avviene sono estremamente brevi. Come sono riusciti, i ricercatori, a registrare dati a tali velocità? È semplice: hanno utilizzato il trucco del Pump and Probe per andare a leggere i cambiamenti della molecola non nel tempo, ma nello spazio. “Andare a misurare nel tempo è molto difficile”, ammette Mauro Nisoli. Invece, misurare lo spazio è abbastanza facile. Allora “trasformiamo la difficoltà temporale in difficoltà spaziale: prendiamo due impulsi (quello X-UV e quello Vis-IR, n.d.r.) e li ritardiamo, di pochi nanometri nello spazio. Questo corrisponde ad alcuni attosecondi”. Il trucco è dato dal fatto che regolare il ritardo fra “pump” e “probe” di alcuni nanometri è facile: si può utilizzare un interferometro. “Possiamo farlo in modo estremamente preciso, e questo corrisponde nel tempo a tempi che possono essere anche di pochi attosecondi”. Questo si può fare proprio perché viene impiegato un secondo impulso che strappa un secondo elettrone.
Riassumendo: i ricercatori hanno registrato come si spostino i vari elettroni in seguito allo stimolo dato dalla rimozione di uno di essi. Naturalmente, si vede soltanto il risultato del “furto” del primo elettrone, e non quello del secondo: per vedere anche questo servirebbe una terza radiazione luminosa, che vada a strappare alla molecola un ulteriore elettrone.
“Togliere il secondo elettrone”, conferma Nisoli, “è il nostro trucco sperimentale per vedere l’effetto della mancanza del primo”.